お客様の認証情報を現在確認中です。
甲状腺眼症治療用IGF-1R阻害剤テッペーザの有効性と安全性
甲状腺眼症(TED)患者を対象とした海外第Ⅲ相、オープンラベル継続試験(海外データ)
承認時評価資料:活動性甲状腺眼症患者を対象とした海外第Ⅲ相試験(HZNP-TEP-302試験)(2024年9月24日承認、CTD2.7.6.6)
Douglas R.S. et al.: J Ophthalmology. 2022; 129(4): 438-449.
COI:本試験はAMGEN社(旧HorizonTherapeutics社)の資金により行われた。
著者にAMGEN社(旧HorizonTherapeutics社)よりコンサルタント料等を受領した者、同社の株式を保有している者及び社員が含まれる。
(1)試験概要
目的
先行試験[HZNP-TEP-301試験(OPTIC試験)]に参加した甲状腺眼症(TED)患者のうち、OPTIC試験の投与24週時に眼球突出非奏効例であった患者、又は投与24週時に眼球突出奏効例であったがOPTIC試験の追跡調査期間中に再発して再投与の基準を満たした患者を対象に、テッペーザ®の有効性及び安全性について検討する。
試験デザイン
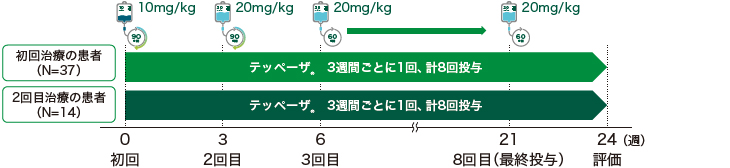
対象
OPTIC試験でプラセボを投与されていた患者(以下、初回治療の患者)37例
OPTIC試験でテッペーザ®を投与されていた患者(以下、2回目治療の患者)14例
試験方法
- 本試験は、投与期間(24週間)及び追跡調査期間(24週間)から構成された。
- OPTIC試験の投与期間終了時(投与24週時)の眼球突出非奏効例(試験眼の眼球突出の減少が2mm未満)を本試験に適格とした。OPTIC試験の投与24週時の眼球突出奏効例のうち、追跡調査期間中に再発して再投与の基準を満たした患者も本試験に組入れ可能とした。
- 再発の基準を、投与24週以降に試験眼で眼球突出が投与24週時から2mm以上増加、又はCASが4点以上かつ投与24週時から2点以上増加した場合とした。本基準に加えて、治験責任医師が患者の症状から再発を確認した(新たな複視の発現など)。
- 本試験を通して、OPTIC試験で投与された治験薬(テッペーザ®又はプラセボ)の遮蔽化が維持された。
- 24週間の投与期間に、全ての患者に対して、オープンラベル下でテッペーザ®を3週間間隔で8回投与した。
- テッペーザ®の用量を、初回投与では10mg/kg、その後7回の投与では20mg/kgとした。
- 初回及び2回目の投与では90分かけて投与し、忍容性が良好な場合、3回目以降の投与では60分かけて投与した。
- 本試験のベースライン来院(Day 1)は、OPTIC試験の最終来院(眼球突出非奏効例では投与24週、再発患者では投与72週までの来院)後14日以内に実施された。
- OPTIC試験の眼球突出非奏効例に対しては、本試験の投与期間の後に24週間の追跡調査期間を設けた。
評価項目
OPTIC試験のベースライン時(Day 1)に重症度が高いと判断された側の眼を「試験眼」とし、逆側の眼を「僚眼」とした。両眼で有効性を評価したが、主要解析には試験眼を用いた。
[主要評価項目]
- 投与24週時の眼球突出奏効率[試験眼の眼球突出がベースラインから2mm以上減少し、かつ僚眼で悪化(2mm以上の増加)が認められない患者の割合]
[副次評価項目]
- 投与24週時のCAS奏効率(試験眼のCASが0点又は1点であった患者の割合)
- 投与24週時までの試験眼での眼球突出のベースラインからの平均変化量
- 投与24週時の複視奏効率[ベースラインに試験眼で複視がグレード1以上であった患者のうち、試験眼が1グレード以上減少し、かつ僚眼で悪化(1グレード以上の増加)が認められなかった患者の割合]
- 投与24週時までのGO-QoL(総合スコア)のベースラインからの平均変化量
[安全性評価項目]
- 有害事象 等
解析計画
以下の解析対象集団を定義した。
-
ITT(intent-to-treat)集団:
組み入れられた(同意取得が得られた)全ての患者。有効性及び安全性の解析で用いた。
以下のベースラインを定義した。
-
OPTIC-Xベースライン:
本試験での治験薬初回投与前の最後の測定値(計画外来院時の測定値も含む)。本試験で治験薬初回投与前に測定値が得られなかった場合は、OPTIC試験での最後の測定値を使用した。 -
テッペーザ®投与ベースライン:
OPTIC試験及び本試験を通したテッペーザ®初回投与前の最後の測定値(計画外来院時の測定値も含む)。
全ての有効性評価項目について記述統計量を算出し、OPTIC試験で投与された治験薬別及び全体の結果を示した。
[主要評価項目]
- 眼球突出奏効率について、来院ごとにOPTIC試験で投与された治験薬別に要約した。追跡調査期間ではOPTIC試験の眼球突出非奏効例のみを対象とし、評価が欠測であった患者は非奏効例とみなした。
[副次評価項目]
- 副次評価項目についても同様に要約した。
[安全性評価項目]
- 安全性評価項目について記述統計量を算出し、OPTIC試験で投与された治験薬別及び全体の結果を示した。
- 有害事象をICH国際医薬用語集(MedDRA)Version 20.1を用いてコード化した。
- 本試験でのテッペーザ®初回投与(投与1日)から最終投与3週(21日)後までに報告された事象を治験薬投与下で発現した有害事象(TEAE)と定義した。
- TEAEを、器官別大分類(SOC)及び基本語(PT)別に示した。各TEAEと治験薬との因果関係を、治験責任医師及び治験依頼者が分類した。注目すべきTEAEとして、潜在的な注入に伴う反応、アナフィラキシー反応、聴覚障害、高血糖、筋痙縮、及び下痢を解析した。
- テッペーザ®を投与された患者を対象に抗薬物抗体(ADA)陽性であった患者の割合を示した。ADA陽性が確認された検体を1つ以上有した患者をADA陽性例とした。
CAS:Clinical Activity Score
GO-QoL:バセドウ病眼症の生活の質に関する質問票
(2)患者背景
■人口統計学的特性およびベースラインの疾患特性(ITT集団)
| 初回治療の患者 (N=37) |
2回目治療の患者 (N=14) |
全体 (N=51) |
||
|---|---|---|---|---|
| 年齢(歳)、平均値±標準偏差 | 48.5±13.49 | 56.1±11.52 | 50.6±13.32 | |
| 年齢区分、 n(%) |
65歳未満 | 33(89.2) | 10(71.4) | 43(84.3) |
| 65歳以上 | 4(10.8) | 4(28.6) | 8(15.7) | |
| 性別、 n(%) |
女性 | 27(73.0) | 11(78.6) | 38(74.5) |
| 男性 | 10(27.0) | 3(21.4) | 13(25.5) | |
| 人種、 n(%) |
アジア人 | 1(2.7) | 2(14.3) | 3(5.9) |
| 黒人/アフリカ系アメリカ人 | 1(2.7) | 1(7.1) | 2(3.9) | |
| 白人 | 33(89.2) | 11(78.6) | 44(86.3) | |
| その他 | 2(5.4) | 0 | 2(3.9) | |
| 身長(cm)、平均値±標準偏差 | 168.0±10.68 | 167.5±9.25 | 167.9±10.22 | |
| 体重(kg)、平均値±標準偏差 | 79.0±19.39 | 72.5±19.08 | 77.2±19.34 | |
| BMI(kg/m2)、平均値±標準偏差 | 27.9±5.65 | 25.6±4.70 | 27.2±5.46 | |
| 喫煙歴 n(%) |
過去に喫煙歴あり | 7(18.9) | 2(14.3) | 9(17.6) |
| 喫煙者 | 8(21.6) | 2(14.3) | 10(19.6) | |
| 喫煙歴なし | 17(45.9) | 10(71.4) | 27(52.9) | |
| 不明 | 5(13.5) | 0 | 5(9.8) | |
| 飲酒歴 n(%) |
過去に喫煙歴あり | 1(2.7) | 0 | 1(2.0) |
| 飲酒習慣あり | 18(48.6) | 9(64.3) | 27(52.9) | |
| 飲酒習慣なし | 13(35.1) | 5(35.7) | 18(35.3) | |
| 不明 | 5(13.5) | 0 | 5(9.8) | |
| HbA1c(%)、平均値±標準偏差 | 5.5±0.35 | 5.7±0.22 | 5.5±0.34 | |
| バセドウ病の罹病期間(年)、平均値 | 2.702 | 4.726 | 3.258 | |
| 甲状腺眼症の罹病期間(月)、平均値 | 12.263 | 16.521 | 13.432 | |
(3)有効性
投与24週時の眼球突出奏効率[主要評価項目]
初回治療の患者では、OPTIC-Xベースラインに対する投与24週時の眼球突出奏効率は89.2%でした。初回治療終了時の眼球突出非奏効例5例のうち2例、初回治療終了時の眼球突出奏効例で再燃した8例のうち5例で、2回目治療による眼球突出に対する奏効を認めました。
■投与24週時の眼球突出奏効率(試験眼、ITT集団)
| 評価項目 |
初回治療の患者 (N=37) |
||
|---|---|---|---|
|
初回治療終了時 眼球突出非奏効例b) (5例) |
初回治療時 眼球突出奏効例b)で再燃 (9例) |
||
| 奏効率a) | 89.2(33/37) | 2/5 | 5/8c) |
b)10例未満であるため奏効例数のみ表記
c)1例は有効性評価対象から除外
副次評価項目
投与24週時における各副次評価項目のデータは以下のとおりでした。
| 評価項目 | 初回治療の患者 (N=37) |
初回治療後、 2回目治療を受けた患者 (14例) |
|---|---|---|
| 投与24週時のCAS奏効率a) | 65.6 (21/32) |
36.4 (4/11) |
|
投与24週時までの眼球突出の ベースラインからの平均変化量b) |
-3.47 | -1.77 |
| 投与24週時の複視奏効率c) | 60.9 (14/23) |
3/4d) |
|
投与24週時までのGO-QoL(総合スコア)の ベースラインからの平均変化量b) |
13.39 | 14.73 |
b)変化量は最小二乗平均値、群間差は調整済み平均[95%信頼区間]mm
c) ベースラインに試験眼で複視がグレード1以上であった患者のうち、試験眼で1グレード以上減少し、かつ僚眼で悪化(1グレード以上の増加)が認められなかった患者
d)10例未満であるため奏効例数のみ表記
(4)安全性
投与期間
- 副作用は、初回治療の患者の70.3%(26/37例)に認められ、2回目治療の患者の50.0%に認められました。
- 主な副作用は、初回治療の患者では筋痙縮 45.9%(17/37例)、下痢、味覚異常が各 10.8%(4/37例)、疲労、脱毛症、皮膚乾燥、爪破損が各 8.1%(3/37例)であり、2回目治療の患者では、筋痙縮 21.4%(3/14例)、鼻乾燥、皮膚乾燥が各 14.3%(2/14例)でした。
- 重篤な副作用は認められませんでした。
- 投与中止に至った副作用は、初回治療の患者1例に認められました。OPTIC試験で発現した軽度の筋痙縮が悪化し、重症度が中等度となったため、投与中止に至りました。
- 本試験の投与期間中に死亡は認められませんでした
■投与期間:2例以上に発現した副作用(ITT集団)
|
初回治療の 患者(N=37) |
2回目治療の 患者(N=14) |
|
|---|---|---|
| 副作用 | 26(70.3) | 7(50.0) |
| 血液およびリンパ系障害 | 2(5.4) | 0 |
| 血小板減少症 | 2(5.4) | 0 |
| 耳および迷路障害 | 2(5.4) | 1(7.1) |
| 耳鳴 | 2(5.4) | 0 |
| 胃腸障害 | 6(16.2) | 1(7.1) |
| 下痢 | 4(10.8) | 0 |
| 一般・全身障害および 投与部位の状態 |
4(10.8) | 1(7.1) |
| 疲労 | 3(8.1) | 0 |
| 筋骨格系および 結合組織障害 |
17(45.9) | 3(21.4) |
| 筋痙縮 | 17(45.9) | 3(21.4) |
|
MedDRA Version.20.1 |
|
初回治療の 患者(N=37) |
2回目治療の 患者(N=14) |
|
|---|---|---|
| 神経系障害 | 6(16.2) | 0 |
| 味覚異常 | 4(10.8) | 0 |
| 生殖系および乳房障害 | 3(8.1) | 0 |
| 無月経 | 2(5.4) | 0 |
| 呼吸器、胸郭および 縦郭障害 |
1(2.7) | 2(14.3) |
| 鼻乾燥 | 0 | 2(14.3) |
| 皮膚および皮下組織障害 | 10(27.0) | 4(28.6) |
| 脱毛症 | 3(8.1) | 1(7.1) |
| 皮膚乾燥 | 3(8.1) | 2(14.3) |
| 爪破損 | 3(8.1) | 0 |
|
n(%) |





 新規会員登録
新規会員登録 でログイン
でログイン