活動性甲状腺眼症
本剤の対象患者は甲状腺眼症患者のうち、活動性の患者です。
活動性甲状腺眼症の患者のみに使用してください。
本剤の効能又は効果
活動性甲状腺眼症
本剤の対象患者は甲状腺眼症患者のうち、活動性の患者です。
活動性甲状腺眼症の患者のみに使用してください。
効能又は効果に関する注意
本剤投与時に、聴覚障害(難聴、聴力低下、耳管機能障害、耳管開放、聴覚過敏、耳鳴、鼓膜障害等)があらわれることがあり、重篤かつ不可逆的な事象も報告されている。「テッペーザ®の有効性と安全性」の項の内容を熟知し、臨床試験で対象とされた患者背景、並びに本剤の有効性及び安全性の試験結果等も十分に理解した上で、適用患者を選択すること。軽症の活動性甲状腺眼症を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
聴覚障害に関しては、「重要な特定されたリスク 聴覚障害」をご参照ください。
甲状腺眼症の活動性は、CAS(Clinical activity score)又はMRIで評価します。
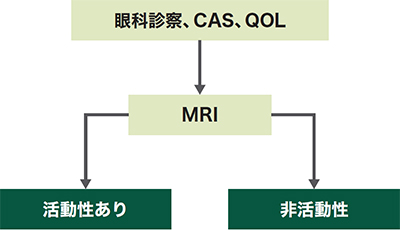
下記の場合は、活動性眼症を示唆します。
日本甲状腺学会・日本内分泌学会編:甲状腺眼症診療の手引き メディカルレビュー社
日本甲状腺学会・日本内分泌学会 編集: バセドウ病悪性眼球突出症(甲状腺眼症)の診断基準と治療指針2023(第3次案). 2023
https://www.japanthyroid.jp/doctor/img/basedou03_2023.pdf(2024年10月閲覧)
国内第Ⅲ相試験(HZNP-TEP-303試験)における甲状腺眼症患者の選択基準は以下の通りでした。
過去に甲状腺眼症の治療を目的とした眼窩への放射線療法又は外科的療法を受けた患者、累積投与量がメチルプレドニゾロン換算1g以上のステロイド薬使用歴がある患者、及び試験開始前から4週間以内に甲状腺眼症以外の治療を目的としたコルチコステロイド薬による治療を受けた患者は除外しました。
※臨床試験において本剤24週投与を3回以上繰り返したときの成績は得られていません。
承認時評価資料:活動性甲状腺眼症患者を対象とした国内第Ⅲ相試験(HZNP-TEP-303試験)(2024年9月24日承認、CTD 2.7.6.5)
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊娠又は妊娠している可能性のある女性
|
本剤の成分※に対し 過敏症の既往歴のある患者 |
本剤に含まれる成分で過去に過敏症が認められた患者には投与しないで ください。 |
|---|---|
|
妊娠又は妊娠している 可能性のある女性 |
本剤の動物試験の結果及びIGF-1受容体を阻害する作用機序から、胎児に 有害な作用を与える可能性があることから設定しました。妊娠又は妊娠 している可能性のある女性には投与しないでください。 |
※ 本剤1バイアル中に下記成分を含む
| 有効成分 (1バイアル中)注1) |
テプロツムマブ(遺伝子組換え)注2) | 524mg |
|---|---|---|
| 添加剤 (1バイアル中)注1) |
L-ヒスチジン | 8.19mg |
| L-ヒスチジン塩酸塩水和物 | 35.02mg | |
| ポリソルベート 20 | 1.10mg | |
| トレハロース水和物 | 1040mg |
| 有効成分注1 | |
|---|---|
| テプロツムマブ(遺伝子組換え)注2) | 524mg |
| 添加剤注1) | |
| L-ヒスチジン | 8.19mg |
| L-ヒスチジン塩酸塩水和物 | 35.02mg |
| ポリソルベート 20 | 1.10mg |
| トレハロース水和物 | 1040mg |
注1)調製時の損失を考慮し、1バイアルからテプロツムマブ(遺伝子組換え)500mgが投与できるよう、過量充填されている。
注2)本剤は遺伝子組換え技術によりチャイニーズハムスター卵巣細胞を用いて産生される。